商机详情 -
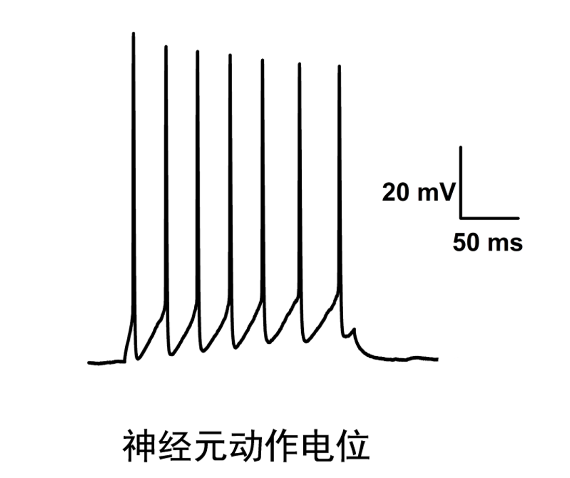
宁波医学实用膜片钳方案
膜片钳技术是一种记录通过离子通道的离子电流来反映细胞膜上离子通道分子活动的技术。是用来研究单个离体的活细胞、组织切片或细胞膜片离子流的电生理实验技术。这项技术在可兴奋细胞如神经元、心肌细胞、肌纤维和胰腺细胞的研究中起至关重要的作用,也可用于研究特殊制备的巨型球状体中的细菌离子通道。传统膜片钳技术对实验人员的技术要求非常高,一般地,实验人员需要经过严格的长期的训练,才能准确且快速的操作。膜片钳技术是用于纪录全细胞或个别细胞膜上离子信道电生理特性的研究方法膜片钳技术用于纪录全细胞或个别细胞膜上离子信道电生理特性的研究方法。宁波医学实用膜片钳方案

膜片钳技术基本原理与特点:高阻封接技术还很大降低了电流记录的背景噪声,从而戏剧性地提高了时间、空间及电流分辨率,如时间分辨率可达10 μs、空间分辨率可达1平方微米及电流分辨率可达10-12 A。影响电流记录分辨率的背景噪声除了来自于膜片钳放大器本身外,比较主要还是信号源的热噪声。一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。宁波医学实用膜片钳方案膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道面积为几个平方微米的细胞膜通过负压吸引封接起来。
膜片钳电生理记录技术:膜片钳技术的基本原理:膜片钳技术用特制的玻璃微吸管吸附于细胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜光有少数离子通道。然后对该膜片实行电压钳位,测量单个离子通道开放产生的微小电流,这种通道的开放是一种随机过程。通过观测单个通道开放的电流幅值分布、开放概率、开放寿命分布等功能参数,并分析它们与膜电位、离子浓度等之间的关系。将该部分细胞采用负压吸破,可以形成比较常见的全细胞记录模式,可以研究整个细胞的生理功能和离子通道电生理功能。
膜片钳技术基本原理与特点:膜片钳技术本质上也属于电压钳范畴,两者的区别关键在于:①膜电位固定的方法不同;②电位固定的细胞膜面积不同,进而所研究的离子通道数目不同。电压钳技术主要是通过保持细胞跨膜电位不变,并迅速控制其数值,以观察在不同膜电位条件下膜电流情况。因此只能用来研究整个细胞膜或一大块细胞膜上所有离子通道活动。目前电压钳主要用于巨大细胞的全性能电流的研究,特别在分子克隆的卵母细胞表达电流的鉴定中发挥着其他技术不能替代的作用。膜片钳使用操作流程及注意事项:电热加热线温度很高,在使用时注意避免烫伤。

膜片钳在通道研究中的重要作用:用膜片钳技术可以直接观察和分辨单离子通道电流及其开闭时程、区分离子通道的离子选择性、同时可发现新的离子通道及亚型,并能在记录单细胞电流和全细胞电流的基础上进一步计算出细胞膜上的通道数和开放概率,还可以用以研究某些胞内或胞外物质对离子通道开闭及通道电流的影响等。同时用于研究细胞信号的跨膜转导和细胞分泌机制。结合分子克隆和定点突变技术,膜片钳技术可用于离子通道分子结构与生物学功能关系的研究。为了测量在不同药物对细胞中的离子通道的影响,通常需要在膜片钳实验中实施灌流。宁波医学实用膜片钳方案
膜片钳使用操作流程及注意事项:拉制仪提前预热(至少30min)。宁波医学实用膜片钳方案
膜片钳的数据如何处理:穿孔膜片(perforated patch)是为克服常规全细胞模式的胞质渗漏问题,有学者将与离子亲和的制霉菌素或二性霉素b经微电极灌流到含有类甾醇的细胞膜上,形成只允许一价离子通过的孔,用此法在膜片上做很多导电性孔道,借此对全细胞膜电流进行记录。由于此模式的胞质渗漏极为缓慢,局部串联阻抗较常规全细胞模式高,所以钳制速度很慢,也称为缓慢全细胞模式。它适合于小细胞的电压钳位,对于直径大于30μm的细胞很难实现钳位。不足之处是由于电极与细胞间交换快,细胞内环境很容易破坏,因此记录所用的电极液应与胞浆主要成分相同,如高k+,低na+和ca2+及一定的缓冲成分和能量代谢所需的物质。膜片钳技术用特制的玻璃微吸管吸附于细胞表面,使之形成10~100MΩ的高阻封接,被孤立的小膜片面积为微米数量级,因此封接范围内细胞膜光有少数离子通道。宁波医学实用膜片钳方案